5 Perkembangan Teori Atom Dari Masa Ke Masa, Lengkap Penjelasan dan Gambar
Perkembangan teori atom berawal
dari konsep materi Demokritus yang menyatakan bahwa jika suatu materi dibagi
menjadi bagian yang lebih kecil, lalu dibagi lagi hingga pada suatu
saat diperoleh bagian terkecil yang tidak dapat dibagi lagi yang disebut Atom.
Pengertian Atom adalah suatu satuan dasar materi yang terdiri dari inti atom dan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri dari proton (bermuatan positif) dan neutron (bermuatan netral), kecuali pada inti atom Hidrogen-1, karena tidak memiliki neutron.
Pengertian Atom adalah suatu satuan dasar materi yang terdiri dari inti atom dan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri dari proton (bermuatan positif) dan neutron (bermuatan netral), kecuali pada inti atom Hidrogen-1, karena tidak memiliki neutron.
Nah, pada kesempatan kali ini akan kita bahas secara lengkap mengenai 5 Perkembangan Teori Atom dari masa ke masa beserta kelebihan dan kekurangannya..
1. Teori Atom Dalton
 |
|
Model Atom Dalton
|
Teori Atom Dalton merupakan sebuah teori tentang atom yang ditemukan oleh John Dalton pada tahun 1803. Menurut John Dalton, teori atom didasarkan pada hukum lavoisier (hukum kekekalan massa) dan hukum prouts (hukum susunan tetap).
Hukum Lavosier menyatakan bahwa “Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi”. Hukum Prouts menyatakan bahwa “Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut diperoleh pokok-pokok teori atom Dalton, diantaranya yaitu:
- Atom
merupakan partikel terkecil yang tidak bisa dibagi lagi.
- Atom
berbentuk bola sederhana dan berukuran sangat kecil.
- Gabungan
beberapa atom akan membentuk suatu senyawa dengan perbandingan bilangan
bulat dan sederhana.
- Atom
tidak dapat diciptakan atau dimusnahkan karena adanya reaksi kimia yang
merupakan pemisahan, penggabungan, atau penyusunan kembali atom-atom.
- Suatu
unsur tersusun dari atom-atom yang sama.
- Suatu
senyawa tersusun dari atom-atom yang berbeda sesuai unsur
penyusunnya.
Adapun kelebihan dan kelemahan dari teori atom Dalton
yaitu sebagai berikut:
Kelebihan
Kelebihan
- Meningkatkan
rasa minat terhadap penelitian model atom berikutnya.
Kelemahan
- Tidak
dapat menjelaskan tentang bagaimana cara atom-atom saling berikatan.
- Tidak
dapat menjelaskan hubungan antara larutan senyawa dengan daya hantar arus
listrik, karena atom merupakan bagian terkecil dari suatu unsur yang tidak
bisa dibagi lagi.
- Tidak
dapat menjelaskan sifat listrik materi.
- Tidak
dapat menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur
yang lain.
2. Teori Atom
Thomson

|
|
|
Model Atom Thomson
|
Teori J.J. Thomson memperbaiki kelemahan dari teori atom Dalton dengan penemuannya yaitu elektron pada tahun 1897. Elektron adalah partikel yang bermuatan negatif.
Penemuan elektron oleh J.J. Thomson diperoleh melalui percobaan tabung sinar katode. Berdasarkan percobaan tabung sinar katode, J.J. Thomson menyimpulkan bahwa sinar katode merupakan sebuah partikel, karena dapat memutar baling-baling yang diletakkan diantara anode dan katode. Partikel tersebut merupakan partikel penyususn atom yang bermuatan negatif yang kemudian disebut dengan elektron.
Isi dari teori atom Thomson yaitu atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar elektron yang bermuatan negatif. Teori ini disebut juga sebagai teori roti kismis. Mengapa demikian? Karena roti digambarkan sebagai atom yang bermuatan positif dengan melekatnya kismis disekeliling roti yang digambarkan sebagai elektron yang bermuatan negatif.
Adapun kelebihan dan kelemahan dari teori atom Thomson yaitu sebagai berikut:
Kelebihan
- Membuktikan
bahwa atom bukan merupakan bagian terkecil dari suatu unsur. Hal itu
karena Thomson menemukan adanya partikel lain yang
bermuatan negatif dalam atom.
- Membuktikan
bahwa atom bersifat netral yang tersusun dari partikel-partikel yang
bermuatan positif dan negatif.
- Membuktikan
bahwa adanya elektron dalam semua unsur.
Kekurangan
- Tidak
dapat menjelaskan tentang susunan muatan positif dan jumlah elektron dalam
bola.
- Tidak
dapat menjelaskan tentang inti atom.
3. Teori Atom
Rutherford
 |
|
Model Atom Rutherford
|
Teori Atom Rutherford didasarkan pada suatu eksperimen yaitu penembakan partikel alfa terhadap lempeng emas. Eksperimen tersebut dikenal dengan eksperimen 'Geiger-Marsden'. Pada saat itu, Rutherford bersama dua orang muridnya yaitu Hans Geiger dan Erners Masreden melakukan suatu percobaan penembakan partikel/sinar alfa terhadap lempeng tipis emas. Partikel alfa merupakan partikel yang bermuatan positif, bergerak lurus, serta memiliki daya tembus yang besar.
Pada percobaan tersebut sinar alfa yang ditembakkan pada lempeng emas ada yang dibelokkan, dipantulkan dan diteruskan. Tujuan sebenarnya dilakukan percobaan tersebut yaitu untuk membuktikan kebenaran teori atom Thomson, yaitu apakah benar atom merupakan bola pejal yang bermuatan positif yang jika dikenai partikel alfa akan dipantulkan atau dibelokkan.
Hasil yang diperoleh dari percobaan tersebut kemudian
dikembangkan ke dalam hipotesis teori atom Rutherford, diantaranya yaitu :
- Elektron
yang bermuatan negatif bergerak mengelilingi inti atom yang bermuatan
positif dengan kecepatan yang sangat tinggi.
- Atom
mempunyai inti atom (bermuatan positif) yang menjadi pusat massa atom.
- Penyebaran
partikel alfa tidak dipengauhi oleh awan elektron.
- Sebagian
besar dari atom merupakan permukaan yang hampa atau kosong.
- Sebagian
kecil partikel alfa yang lewat akan dibelokkan dan sedikit sekali
dipantulkan. Sebagian besar lainnya tidak mengalami
pembelokkan/hambatan.
Pada tahun 1911, berdasarkan eksperimen Geiger-Marsden, Rutherford menyangkal kebenaran teori atom Thomson yang menyatakan bahwa atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar elektron yang bermuatan negatif. Rutherford menyatakan bahwa atom memiliki inti yang merupakan pusat massa yang dinamakan nukleus yang dikelilingi oleh awan elektron yang bermuatan negatif. Pernyartaan tersebut kemudian dikenal dengan teori atom Rutherford.
Adapun kelebihan dan kelemahan dari teori atom Dalton
yaitu sebagai berikut:
Kelebihan
- Dapat
menggambarkan dan menjelaskan bentuk lintasan elektron yang mengelilingi
inti atom, sehingga mudah dipahami.
- Dapat
menyimpulkan bahwa atom tersusun dari inti atom dan elektron yang
mengelilingi inti atom yang dimana satu sama lain terpisah oleh ruang
hampa.
- Dapat
menjelaskan pergerakan elektron disekitar inti atom
Kekurangan
- Tidak
mampu menjelaskan mengapa elektron tidak pernah jatuh ke dalam inti atom
sesuai dengan teori fisika klasik.
- Tidak
mampu menjelaskan tentang spektrum garis pada atom hidrogen (H).
- Tidak
mampu menjelaskan letak elektron dan cara rotasinya terhadap inti
atom.
- Elektron
yang bergerak akan memancarkan energi, sehingga energi atom menjadi tidak
stabil.
4. Teori Atom
Bohr
|
|
|
Model Atom Neils Bohr
|

Pada tahun 1913, seorang pakar fisika dari Denmark yang bernaman Neils Bohr melakukan eksperimen yaitu spektrum atom hidrogen. Eksperimen tersebut bertujuan untuk menyempurnakan teori atom Rutherford. Eksperimennya ini berhasil menggambarkan keadaan elektron dalam menempati daerah disekitar inti atom.
Penjelasan Bohr mengenai atom hidrogen merupakan gabungan antara teori klasik dari Rutherford dengan teori kuantum dari Planck. Berikut hipotesa (postulat) dari teori atom Bohr, diantaranya yaitu:
- Elektron
dapat berpindah dari orbit satu ke orbit yang lain berdasarkan tingkatan
energi. Elektron akan berpindah ke orbit yang memiliki energi lebih tinggi
jika elektron menyerap energi yang besarnya sama dengan perbedaan energi
antara kedua orbit yang bersangkutan. Sebaliknya, elektron yang berpindah
ke orbit yang memiliki energi lebih rendah akan memancarkan energi radiasi
yang teramati sebagai spektrum garis yang besarnya sama dengan perbedaan
energi antara kedua orbit yang bersangkutan.
- Selama
dalam orbitnya, elektron dalam keadaan stationer dan tidak memancarkan
energi.
- Jika
elektron-elektron berpindah dan menempati orbit yang lebih tinggi, maka
atom dalam molekul berada dalam tingkat tereksitasi (excited state).
Jika elektron-elektron berpindah dan menempati orbit yang lebih rendah,
maka atom dalam molekul berada dalam tingkat dasar (ground state).
- Elektron
mengelilingi inti atom dalam orbit-orbit tertentu yang berbentuk lingkaran
yang sering disebut sebagai kulit-kulit elektron. Kulit-kulit elektron
dinyatakan dalam bentuk notasi K, L, M, N, ... dan seterusnya.
- Energi
yang dimiliki elektron pada masing-masing orbit dapat mempengaruhi besar
kecilnya lingkaran orbit. Semakin tinggi energi elektron dalam orbit maka
semakin besar pula lingkaran orbitnya dan sebaliknya.
Teori atom Bohr dapat digambarkan seperti sebuah tata surya mini (seperti gambar diatas), dimana elektron-elektron yang berada di lintasan beredar mengelilingi inti atom yang bermuatan positif dan berukuran sangat kecil. Namun bedanya, pada sistem tata surya setiap planet hanya menempati 1 lintasan (orbit) saja, sedangkan pada atom setiap elekron bahkan lebih dapat menempati 1 lintasan (kulit atom).
Berdasarkan teori atom Bohr, elektron-elektron yang mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling tinggi adalah kulit elektron yang terletak paling luar serta penomoran kulitnya paling besar, semakin dalam letak kulit elektron maka semakin kecil nomor kulitnya dan semakin rendah tingkat energinya.
Dalam model atom Bohr terdapat susunan elektron pada masing-masing kulit atom yang disebut konfigurasi elektron. Nomor atom suatu unsur merupakan data yang digunakan untuk menuliskan konfigurasi elektron. Nomor atom suatu unsur menyatakan jumlah elektron dalam atom unsur tersebut. Sedangkan elektron pada kulit terluar disebut sebagai elektron valensi. Susunan elektron valensi berperan penting dalam membentuk suatu ikatan dengan atom lain serta menentukan sifat-sifat kimia suatu atom.
Adapun kelebihan dan kelemahan dari teori atom Bohr yaitu sebagai berikut:
Kelebihan
- Dapat
memperbaiki kelemahan dari teori atom Rutherford.
- Dapat
membuktikan adanya lintasan elektron untuk atom hidrogen.
- Dapat
menjelaskan spektrum atom hidrogen secara akurat.
Kekurangan
- Tidak
dapat menjelaskan spektrum warna dari atom-atom yang mempunyai banyak
elektron atau yang lebih kompleks.
- Tidak
dapat menjelaskan adanya garis-garis halus dalam spektrum hidrogen (efek
Zeeman) karena Bohr mengganggap elektron sebagai partikel.
- Model
atom Bohr memiliki nilai momentum sudut lintasan ground state yang
salah.
- Tidak
bisa mengetahui intensitas relatif garis spektra.
- Tidak
bisa menjelaskan struktur garis spektra yang baik.
- Tidak
dapat menjelaskan atom selain atom hidrogen.
5. Teori Atom Modern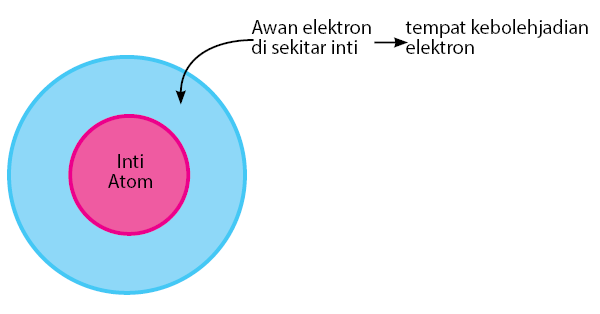

|
|
|
Model Atom Modern
|
Teori atom modern berkembang setelah teori atom Bohr. Pada tahun 1924, seorang ahli fisika prancis yang bernama Louis de Broglie menyempurnakan kelemahan dari teori atom Bohr yang tidak mampu menerangkan model atom selain atom hidrogen serta gejala atom dalam medan magnet. Menurut Broglie, elektron tidak hanya bersifat partikel, elektron juga bisa bersifat gelombang. Sedangkan menurut Neils Bohr, elektron adalah partikel.
Pendapan Louis de Broglie kemudian dikembangkan lagi oleh Edwin Schrodinger dan Werner Heisenberg dan melahirkan teori atom modern. Teori atom modern disebut juga sebagai teori mekanika kuantum. Prinsip dasar teori atom modern adalah gerakan elektron dalam mengelilingi inti bersifat seperti gelombang.
Teori ini digunakan untuk menjelaskan sifat atom dan molekul. Berdasarkan teori mekanika kuantum, kedudukan dan momentum suatu benda tidak mungkin dapat ditentukan secara seksama pada saat bersamaan, yang dapat diketahui hanya kebolehjadian menemukan elektron pada jarak tertentu dari inti atom. Teori tersebut dinamakan prinsip ketidakpastian Heinsenberg yang dikemukakan oleh Werner Heinsenberg, seorang ahli fisika dari Jerman.
Menurut Heisenberg, posisi dan kecepatan elektron yang sedang bergerak secara bersama-sama tidak bisa diukur secara tepat, karena elektron yang bergerak menimbulkan perubahan dalam posisi dan momentum setiap saat.
Prinsip ketidakpastian Heisenberg dan persamaan gelombang oleh Louis de Broglie kemudian dijadikan acuan oleh Erwin Schrodinger untuk merumuskan persamaan Schrodinger, yaitu sebagai berikut:
Sekian artikel tentang 5 Perkembangan Teori Atom Dari Masa Ke Masa.

baguss
BalasHapusMantap kalii����
BalasHapusSangat bermanfaat����✨
BalasHapusSangat bermanfaat ❤️🙏
BalasHapusMantap👍
BalasHapusSangat membantu ��😍
BalasHapusMantapp ndah,semoga bermanfaat🙏🙏
BalasHapusBermanfaat👍
BalasHapusAlhamdulillah setelah membaca ini saya menjadi sungkan untuk belajar
BalasHapusSgt bermanfaat kk terimakasih
BalasHapusSangat bermanfaat mkasih kk
BalasHapussangat bermanfaat bangettsss
BalasHapusMantapppp
BalasHapusDulu saya sering malas belajar tetapi setelah saya datang dan membaca ke blog maripintarkimia saya jadi rajin dan semangat untuk belajar. Terima kasih maripintarkimia ��������
BalasHapusBagus 👏 sangat membantu saya untuk belajar kimia
BalasHapusGood
BalasHapusMantull
BalasHapuspenulisannya sangat mudah dipahami ,yang awalnya gak niat buat belajar sekarang jdi mau trrus belajar .trmskasih kakak
BalasHapusMantapppp👍
BalasHapusMantapp
BalasHapusMantapp
BalasHapusSemoga bermanfaat
BalasHapusBagusss.. Ditunggu postingan selanjutnyaa
BalasHapusBermanfaat.Ditunggu postingan berikutnya
BalasHapusblog nya rapi dan sangat bermanfaat
BalasHapusKeren keren
BalasHapusBgus,di tunggu next postingan nya
BalasHapusSanagt bermanfaat, ditunggu postingan yg selanjutnya ya kakak cantik,wkwkw
BalasHapusMantaap....warbiyasaaah....membantu
BalasHapusMantul.sangat membantu sekali👌
BalasHapusPenjelasan nya sangat lengkap sekali
BalasHapusKereeen:)sangat membantu
BalasHapusKereeennn bangettt ,membantu untuk yang kurang paham ketika belajar disekolah
BalasHapusAjarinnn kimia mbakkkk
BalasHapusTerimakasih, sangat membantu
BalasHapusMakasih kak indah ditunggu dipostingan selanjutnya ya muah
BalasHapusKerenn
BalasHapusSangat membantu sekali
sangat bermanfaat kak
BalasHapusTerima kasih, sangat membantu dalam menambah ilmu pengetahuan dasar tentang kimia yaitu pengertian atom, teori pembentukan nya dll dan saya sudah mengerti
BalasHapus👍👍👍👍
BalasHapusMantap
BalasHapussangat bermanfaat semoga semakin bnyak lagi wawasan yang di bagikan lagi terus berkaya kak
BalasHapusMantapp kak👍🏻👍🏻
BalasHapusBagus kk ditunggu postingan selanjutnya
BalasHapusMantapp kali kakak
BalasHapusBagus, sangat membantu sekali ��
BalasHapusGood article
BalasHapusTerima kasih, artikel ini sangat membantu
BalasHapusNice kakak
BalasHapusThanks kak, sangat membantuu:)
BalasHapusAllhamdulillah dgn ada nya ini saya bisa belajar
BalasHapusAlhamdulillah dengan adanya blog kak indah dapat mengingatkan saya tentang teori atom modern, ditunggu kak postingan selanjutnya, terima kasih banyak kak🙏
BalasHapusBagus sekali dan sangat bermanfaat
BalasHapussanfat seru membacanya
BalasHapus